Extracción con fluídos supercríticos en la industria de alimentos
El consumidor manda. El consumidor demanda hoy alimentos simples, con pocos ingredientes, como los que podemos encontrar en la cocina de nuestra casa. Ese es el concepto de etiqueta limpia. Este concepto plantea el desafío de reemplazar aditivos químicos artificiales por otras sustancias naturales que cumplan la misma función tecnológica. Y, además, se prefiere que estas sustancias naturales sean obtenidas mediante técnicas sustentables que no dejen residuos en el alimento ni afecten el ambiente. En este contexto emerge una tecnología que satisface todas estas exigencias: la extracción con CO2 supercrítico. Además, esta tecnología se alinea con los requerimientos de eficiencia, escala y costos que la industria requiere. Conozcamos algo más en el siguiente artículo.
Advertencia: el tema que trataremos en los próximos párrafos puede causar aburrimiento. Pero, no tengan dudas, es muy importante. Así que ahí vamos…
¿Recuerdan las clases de Termodinámica o fisicoquímica? Bien, seguramente allí estudiaron algo que se llama diagrama de fases. La definición nos dice que es una representación gráfica de diferentes estados de la materia, en función de variables elegidas.
Así se comporta un fluido supercrítico.
Los fluidos supercríticos se comportan, en parte como un líquido y en parte como un gas. Tienen una viscosidad mucho más baja que la de los líquidos. Su baja tensión superficial permite una alta penetrabilidad a través de sólidos porosos y lechos empaquetados.
En comparación con los líquidos tienen mayores coeficientes de difusión por lo que la transferencia de materia y la disolución de los solutos son más favorables.
Su comportamiento como gas facilita la separación de la matriz. Esto permite una extracción más rápida, eficiente y selectiva en comparación con una extracción con un solvente líquido.
Un repaso del diagrama de fases y punto triple.
En un diagrama de fases podremos ver en qué estado (sólido, líquido, gaseoso) se encuentra una sustancia para cada par Temperatura-Presión.
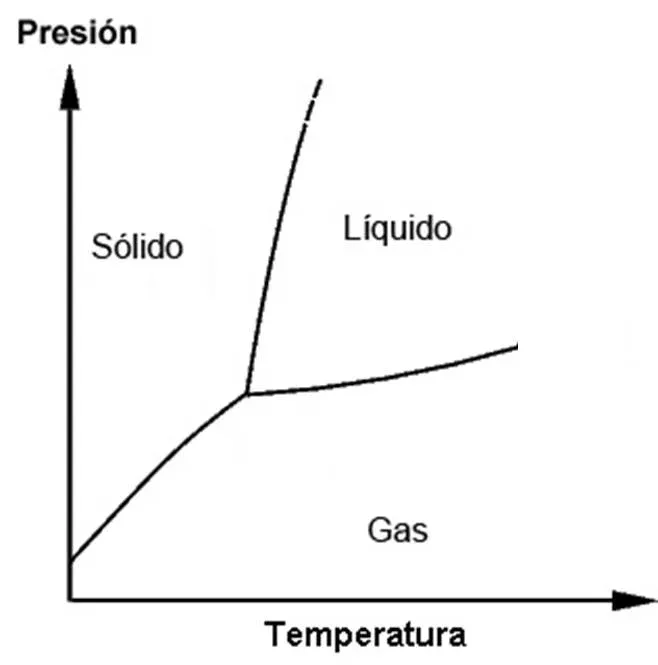
Las líneas representan las interfaces sólido-líquido, sólido-gaseoso y líquido-gaseoso. Estas líneas definen a priori, tres regiones.
Un ejemplo muy sencillo
Visualicemos en el gráfico el punto A. En este punto la sustancia se encuentra en estado sólido. Supongamos que se incrementa la temperatura, a presión constante.
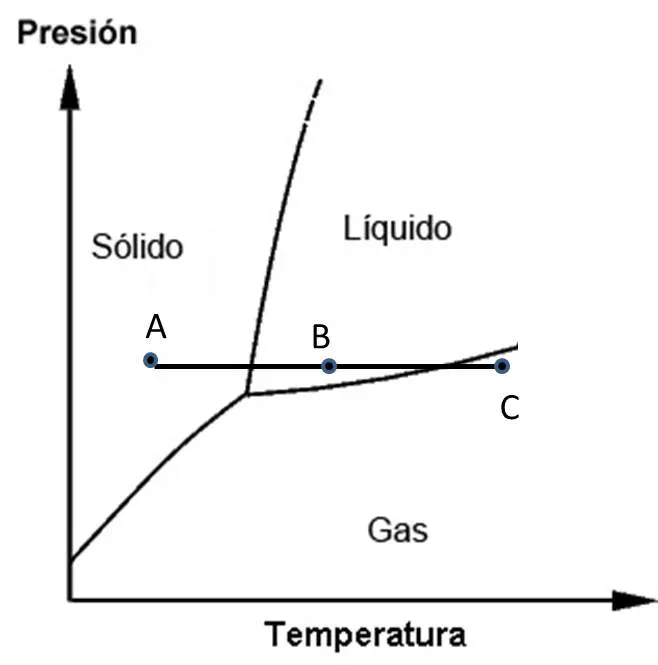
En el gráfico nos desplazamos desde A hasta B. La sustancia pasa de estado sólido a líquido. Si se continúa el aumento de temperatura hasta el punto C (siempre a presión constante) la sustancia pasará a estado gaseoso.
Como dijimos, las líneas representan las interfaces, esto es, las condiciones de presión y temperatura a las que se produce el cambio de estado.
¿Y el punto triple?
Si observan nuevamente el diagrama verán que hay un punto donde se unen las tres líneas. Este punto se conoce “punto triple”.
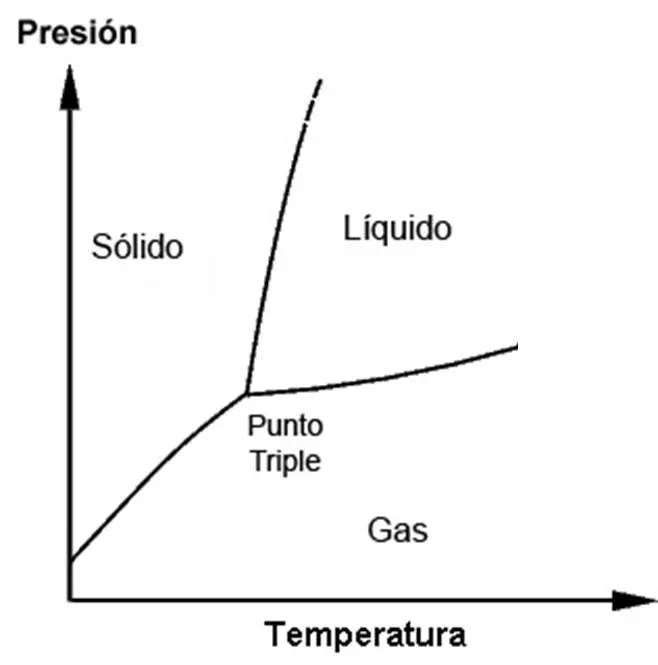
Lo podemos definir como aquel en el cual coexisten en equilibrio los estados sólido, líquido y gaseoso de una sustancia. El punto triple se define con una temperatura y una presión.
Volveremos a mencionar los diagramas de fases cuando tratemos el tema de la liofilización. Por el momento, sigamos avanzando para entender mejor el tema de los fluidos supercríticos.
¿Qué es el punto crítico? ¿Y un fluido supercrítico?
El concepto de punto crítico fue introducido por el fisicoquímico irlandés Thomas Andrews, quien estudió el comportamiento del dióxido de carbono bajo presión a diversas temperaturas. Empleando una muestra de CO2 Thomas observó que a presiones muy altas era posible licuar el gas a temperatura ambiente.
Este experimento condujo a Andrews a sugerir que existía una temperatura crítica para cada gas.
Pero, por encima de 31,10 °C, aun aumentando la presión, no pudo hacer que el gas regresara al estado líquido. El límite entre las regiones del gas y del líquido desaparece.
Por encima de esta temperatura, el gas no puede licuarse aplicando únicamente presión.
En este punto (a presión y temperatura críticas) la densidad del gas se iguala con la densidad del líquido. Este punto se conoce como punto crítico.
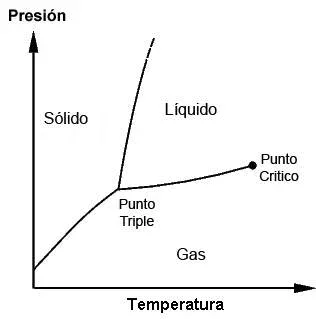
El punto crítico del agua es 218,3 atm y 647,3 K. El del CO2, 72,8 atm y 304,1 K.
Cuando cualquier sustancia que se encuentre en condiciones de presión y temperatura superiores a su punto crítico estamos en presencia de un fluido supercrítico
A temperaturas superiores a la crítica no es posible generar una fase líquida condensada por elevación de la presión. El fluido supercrítico pasa directamente a líquido, si se reduce la temperatura en condiciones isobaras, o a gas si se disminuye la presión.
¿Por qué tendría que usar CO2?
Dentro de los fluidos supercríticos, el dióxido de carbono merece un párrafo especial. Además de las ventajas relativas a la eficiencia de la extracción, el CO2 resulta amigable con el ambiente, al ser menos contaminante que los habituales solventes orgánicos.
Una limitante en el uso del CO2 es su naturaleza apolar que, en principio, limita su poder solvente para sustancias polares.
Existe una alternativa que consiste en la adición de pequeñas cantidades de sustancias polares (etanol, agua supercrítica) que añadidas al CO2 varían enormemente la polaridad.
Una vez que el compuesto deseado se disuelve en CO2 supercrítico, el extracto puro puede obtenerse fácilmente por simple despresurización. El CO2, pasa a ser gas de nuevo y el extracto, se recupera en forma sólida o líquida. En teoría, cualquier material sólido poroso puede ser tratado por extracción con fluido supercrítico para recuperar compuestos valiosos (aceites, fragancias, pigmentos) y también para eliminar sustancias no deseadas (contaminantes, disolventes residuales).
Aplicaciones de los fluidos supercríticos en la industria de alimentos
En este artículo mencionaremos aplicaciones de fluidos supercríticos en operaciones de extracción. Sin embargo, su aplicación se extiende a procesos de impregnación, formación de partículas, formulación, esterilización, limpieza y reacciones químicas entre otros.
Aceite de pepita de uva
La industria vinícola genera gran cantidad de residuos orgánicos que deben ser adecuadamente administrados para evitar posibles impactos medioambientales derivados de su vertido al medio ambiente. Pero por otra parte, ofrece la posibilidad de la valorización de los residuos vinícolas mediante recuperación de sustancias de valor comercial. Este aprovechamiento constituye al aumento de la sostenibilidad de la actividad y su integración con el medio natural.
Una de las posibilidades es el aprovechamiento de las pepitas de uva para la obtención de aceite.
Diferentes trabajos de investigación han demostrado que la extracción del aceite mediante extracción supercrítica es viable. Los rendimientos son comparables a la extracción con hexano. También es comparable la calidad del aceite obtenido.
Colorantes
El color de los alimentos influye en las decisiones de compra, ya que condiciona la percepción que el consumidor tiene del producto. Por esta razón es masivo el uso de aditivos colorantes.
Los colorantes son añadidos a los alimentos porque:
- dan color a alimentos que de forma natural carecen de él,
- aportan un aspecto uniforme a los colores naturales, aumentando su atractivo visual
- mantienen las cualidades organolépticas relativas al color en aquellos alimentos en los que el procesado puede modificarlos.
La preferencia por los productos libres de aditivos se extiende también a los colorantes. Por esta razón, en reemplazo de los aditivos, se utilizan extractos de alimentos con propiedades colorantes (también conocidos como productos alimenticios colorantes).
La tecnología basada en la extracción a través de fluidos supercríticos está demostrando ser una opción técnica viable y está permitiendo el avance tecnológico necesario para proporcionar a la industria alimentaria los colorantes naturales que demanda.
¿Cómo será el futuro de la extracción supercrítica?
¿Los consumidores somos conscientes de los beneficios que las nuevas tecnologías de procesamiento de alimentos pueden brindarnos? ¿Estarías dispuesto a pagar más por un alimento natural, libre de aditivos? ¿Estaría la industria de alimentos preparada para satisfacer esa demanda? Queremos conocer tu opinión.
